Như đã đề cập ở trên, mục đích đầu tiên của việc Polyethylene glycol PEG hóa là giảm tính sinh miễn dịch của chất mang PAMAM. Ngoài ra, với tính chất đặc biệt của Polyethylene glycol PEG là vừa có khả năng tan tốt trong nước vừa có thể tan được trong dầu nên khi PEG kết hợp với PAMAM sẽ tăng khả năng hydrate hóa trên bề mặt, tạo thuận lợi cho việc dẫn các thuốc kỵ nước trong cơ thể [62]. Một lợi ích khác nữa là khi lai hóa những chuỗi Polyethylene glycol PEG có khối lượng phân tử lớn (550, 2000, 5000,…), các nhóm bên ngoài PAMAM trở nên đông đúc và chằng chịt hơn, những chuỗi Polyethylene glycol Polyethylene glycol PEG co lại nhốt các phân tử thuốc, làm tăng khả mang thuốc lẫn kiểm soát quá trình giải phóng thuốc [17, 59].
Năm 2000, Chie Kojima và cộng sự đã tổng hợp PAMAM ở thế hệ 3.0 và 4.0 gắn kết với MPEG khối lượng phân tử 550 và 2000. Sau đó, nhóm nghiên cứu đã sử dụng sản phẩm PAMAM-MPEG nang hóa và khảo sát sự giải phóng thuốc của hai loại thuốc trị ung thư có tính ái dầu là adriamycin (ADR), methotrexate (MTX). Kết quả là sản phẩm PAMAM 4.0 kết hợp với MPEG 2000 sẽ mang được 6,5% ADR và 26% MTX. Thuốc MTX được nang hóa trong PAMAM-MPEG được phóng thích ra một cách từ từ trong dung dịch nước [59].
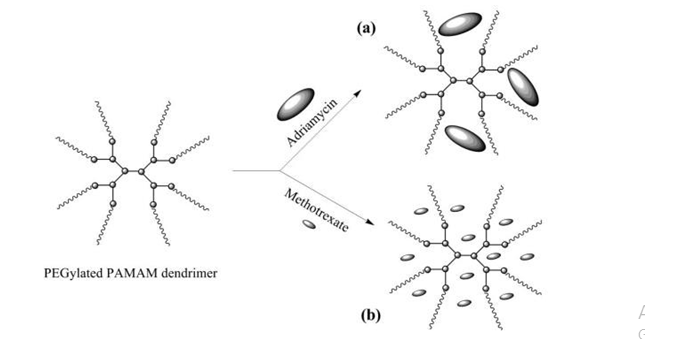
Sự kết hợp của PEG-PAMAM với adriamycin (a), methotrexate (b)
Không những vậy, một số nghiên cứu khác cũng chỉ ra rằng việc lai hóa Polyethylene glycol PEG còn kéo dài thời gian lưu của dendrimer trong tuần hoàn máu. Dendrimer không lai hóa nhanh chóng bị thải trừ khỏi máu và tập trung ở các cơ quan như gan hay thận chỉ sau vài phút hay vài giờ. Theo nghiên cứu của Kukowska-Latallo [63], PAMAM G5.0 đánh dấu tritium được cơ thể nhanh chóng đào thải qua đường thận chỉ trong 24 h sau khi tiêm. Trong một nghiên cứu khác [70], PAMAM được đánh dấu với đồng vị 125I và tiêm thử nghiệm vào chuột Wistar, sau 1 h chỉ còn khoảng 1% lượng PAMAM lưu lại trong máu và hơn 60% lượng PAMAM đã tập trung tại gan. Nhưng khi lai hóa với Polyethylene glycol PEG, thời gian lưu trong tuần hoàn chung được tăng lên đến 24 h, dendrimer chủ yếu được phân bố trong máu hơn là ở các cơ quan khác, nhờ đó kéo dài thời gian bán thải và giảm độ thanh thải của thuốc.
Cũng trong nghiên cứu của nhóm Bhadra năm 2003 [17], thuốc chống ung thư 5-Fluorouracil được lần lượt nang hóa trong chất mang PAMAM G4.0 không lai hóa và lai hóa 25% bề mặt với MPEG 5000. Kết quả khảo sát in vitro cho thấy so với PAMAM không lai hóa, PAMAM lai hóa có khả năng mang lượng thuốc gấp đến 12 lần và tốc độ giải phóng thuốc giảm đi 6 lần, thời gian phóng thích thuốc hoàn toàn kéo dài đến 6 ngày. Nhóm nghiên cứu tiếp tục tiến hành so sánh in vivo trên chuột và kết quả cũng tương tự. Khi không PEG hóa, nồng độ cực đại của thuốc trong huyết tương cao, thời gian đạt nồng độ cực đại nhanh (Cmax =21-23 µg/mL, tmax =3 h) và kết quả là thời gian lưu của thuốc trong tuần hoàn thấp (6-7 h). Còn khi PEG hóa, nồng độ Cmax giảm đi chỉ còn khoảng 1/3, thời gian đạt được chậm hơn tmax =7 h, mang lại hiệu quả kéo dài thời gian thuốc tồn tại trong huyết tương, lên đến 12 h.
Mô hình PAMAM-MPEG mang thuốc 5-Fluorouracil
Năm 2004, một nghiên cứu khác cũng được H. Yang và các đồng nghiệp tiến hành nhằm khảo sát ảnh hưởng của yếu tố khối lượng của chuỗi Polyethylene glycol PEG lai hóa trên bề mặt. PAMAM G3.0 cũng được chọn và lai hóa với các Polyethylene glycol PEG 750, 2000 và 5000, đạt được mức độ lai hóa lần lượt là 28, 25 và 23/32 nhóm amine bề mặt. Các PAMAM-PEG hóa này được sử dụng để hòa tan pyrene. Kết quả cho thấy PAMAM lai hóa Polyethylene glycol PEG 2000 có khả năng hòa tan pyrene tốt nhất, hơn cả PAMAM lai hóa Polyethylene glycol PEG 5000. Để giải thích điều này, nhóm nghiên cứu cho rằng các chuỗi Polyethylene glycol PEG quá dài có thể bị vướng vào nhau dẫn đến hiệu quả hòa tan giảm [120].
Năm 2008, Shuhua Bai và cộng sự tiếp tục tổng hợp PAMAM-MPEG với MPEG khối lượng phân tử 2000 và PAMAM ở thế hệ G3.0. Sau khi tổng hợp thành công PAMAM-MPEG, nhóm nghiên cứu đã tiến hành nang hóa PAMAM-MPEG với thuốc chống đông máu Heparin (LMWH). Nhờ nang hóa trong cấu trúc PAMAM-MPEG mà độ hấp thu qua đường hô hấp và sinh khả dụng của LMWH tăng 60,6% so với LMWH tiêm dưới da bình thường. Thời gian bán thải của thuốc được nang hóa là 11,9 h; tăng gấp 2,4 lần so với LMWH trong saline thông thường. Đáng chú ý là hiệu quả phóng thích thuốc từ từ của MPEG-PAMAM cho phép giãn khoảng cách giữa hai lần dùng thuốc lên gấp đôi (48 h), mà vẫn bảo đảm hiệu quả như LMWH thông thường tiêm cách quãng 24 h trong việc giảm kích thước huyết khối in vivo trên chuột [100].
Năm 2009 và 2010, hiệu quả mang và giải phóng thuốc của sự lai hóa PEG cũng được khẳng định trong kết quả của một số nghiên cứu khác của Arunvel Kailasan và cộng sự [54], Chie Kojima và cộng sự [24].
Năm 2011, nhóm tác giả Dan Liu và cộng sự đã tổng hợp một copolymer nhạy pH mang thuốc Doxorubicin thử nghiệm trên tế bào ung thư gan của chuột. Cấu tạo của copolymer dựa trên tương tác tĩnh điện giữa PAMAM mang thuốc Doxorubicin (Dox) và poly(methacryloyl sulfadimethoxine) (PSD) nhạy pH. Trên PSD này được gắn với PEG (Polyethylene glycol) để tăng tính tương hợp sinh học và một dẫn xuất của lactose để định hướng đến tế bào gan [27].
Năm 2011, Zhu S và cộng sự đã tổng hợp thành công hệ mang thuốc dendrimer trên cơ sở polyester với chất tương hợp sinh học PEG thông qua liên kết amide và thuốc doxorubicin thông qua cầu nối hydrazone giữa Glu được gắn trên bề mặt dendrimer và doxorubicin (hình 1.35). [123]
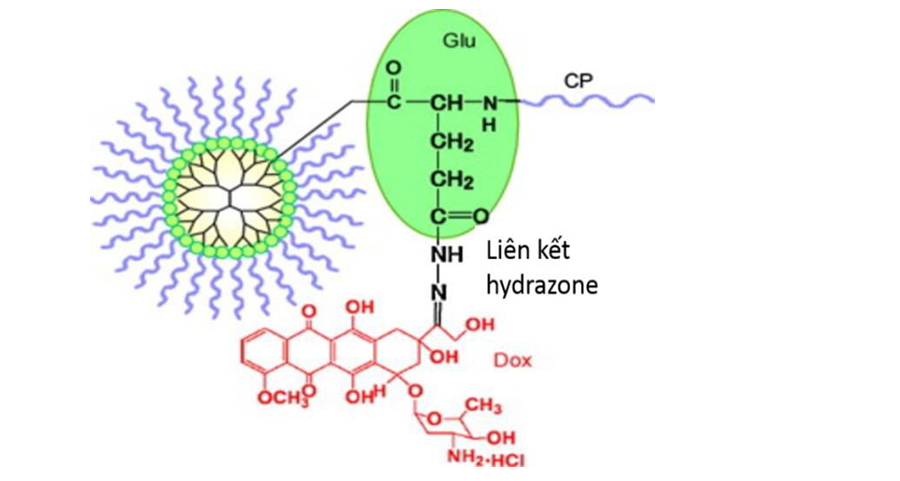
Hình 1.35. Cấu trúc hóa học của PEG-Dendrimer gắn với doxorubicin thông qua mối nối hydrazone
Năm 2013, nhóm tác giả P. Dinesh Kumar và cộng sự thực hiện biến tính PAMAM G4 (G5) bằng MPEG. Trong đó MPEG cũng được hoạt hóa bằng NPC và cho mang thuốc HIV, nhóm tác giả kiểm tra tốc độ giải phóng thuốc in vitro của PAMAM chưa biến tính và đã biến tính trong môi trường đệm PBS. Kết quả cho thấy PAMAM khi được biến tính bằng MPEG cho hiệu quả mang thuốc cao, giải phóng thuốc chậm (hình 1.36) và giảm khả năng gây độc tế bào so với PAMAM khi chưa biến tính [28].
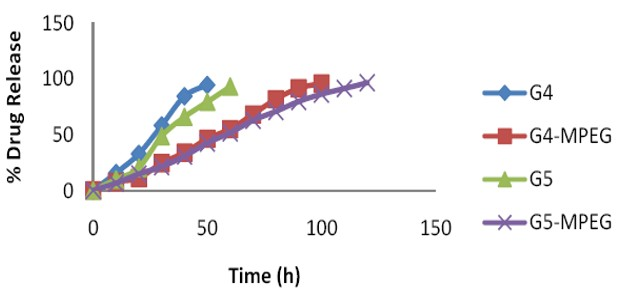
Hình 1.36. Sơ đồ giải phóng thuốc của PAMAM chưa biến tính và PAMAM đã biến tính.
Gần đây nhất năm 2015, Luis F. Barraza và cộng sự cũng chỉ dừng lại ở mức độ biến tính PAMAM G4 bằng PEG mang thuốc 5-FU. Trong đó, PEG được hoạt hóa trước qua một bước NPC bằng hình thức khống chế tỷ lệ 1:1, điều này dễ dẫn đến khả năng PEG bị hoạt hóa cả hai đầu bằng NPC và kết quả có thể PEG liên kết cả 2 đầu vào PAMAM, tạo lớp màng bao phủ bề mặt PAMAM và ngăn cản một phần thuốc không đi vào khoảng trống trong cấu trúc PAMAM. Nhóm tác giả đã thực hiện bước khảo sát ảnh hưởng hiệu quả liên kết PEG 25%-100% lên PAMAM G4 đến hình thức lưu trữ thuốc. Kết quả chỉ ra rằng, hiệu quả biến tính PAMAM G4 bằng PEG đạt trên 50% thì khả năng thuốc 5-FU được mang vào sâu bên trong cấu trúc PAMAM là thấp, thuốc 5-FU chủ yếu tập trung phía gần bên ngoài bề mặt PAMAM, còn đối với hiệu quả biến tính PAMAM G4 bằng PEG đạt khoảng 25% thì lượng thuốc 5-FU được mang vào sâu bên trong cấu trúc PAMAM G4 và kèm theo sự hỗ trợ của các nhóm PEG có hiện tượng gập chuỗi lại giúp khả năng lưu trữ thuốc hiệu quả hơn [67].
Về phía biến tính dendrimer PAMAM bằng Pluronic, đặc trưng cấu trúc của Pluronic cũng có hai nhóm -OH đầu mạch giống với PEG nên việc biến tính dendrimer PAMAM bằng Pluronic bản chất hóa học là như nhau. Quá trình nghiên cứu biến tính dendrimer PAMAM theo hướng Pluronic cũng gần với thời điểm bên hướng PEG, nhưng hướng phát triển chậm hơn, cụ thể:
Từ năm 1998-2004, nhóm nghiêm cứu của Rill R. L [93], Vinogradov S. V [117] và Gebhart C. L [39] cùng các cộng sự đã chỉ ra rằng Pluronic không gây độc tế bào.
Năm 2008, T. H. Dung, J. S. Kim, R. L. Juliano và H. Yoo đã tiến hành nghiên cứu biến tính dendrimer PAMAM G5 bằng Pluronic F127 với các tỷ lệ 1:10, 1:20, 1:30, trong đó Pluronic F127 được hoạt hóa bằng NPC/pyridine (hình 1.37) [110].
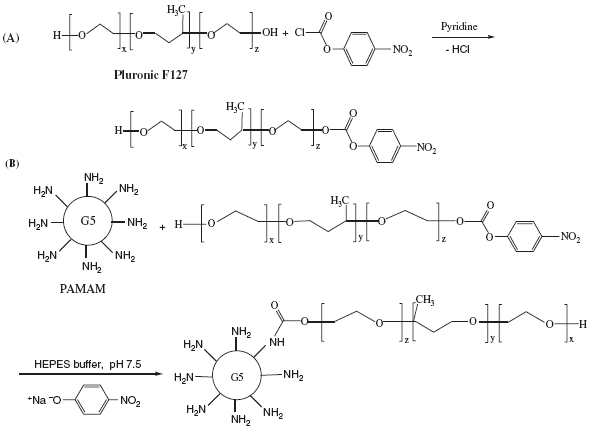
Hình 1.37. Sơ đồ tổng hợp dendrimer PAMAM G5-Pluronic F127
Để hoạt hóa Pluronic F127, nhóm nghiên cứu này đã sử dụng NPC/pyridine tỷ lệ mol Pluronic F127: NPC/pyridine là 1:1, điều này dễ dẫn đến khả năng Pluronic F127 bị hoạt hóa cả hai đầu bằng NPC và kết quả có thể Pluronic F127 liên kết cả 2 đầu vào PAMAM G5, tạo lớp màng bao phủ bề mặt PAMAM G5 và ngăn cản một phần thuốc không đi vào khoảng trống trong cấu trúc PAMAM G5. Ngoài ra, nhóm tác giả còn sử dụng xúc tác pyridine rất độc với môi trường.
Các phương pháp phổ hồng ngoại (FTIR), phổ cộng hưởng từ hạt nhân (1H NMR) được sử dụng để phân tích cấu trúc PAMAM dendrimer và PAMAM dendrimer G5-Pluronic F127 cho thấy pulronic đã liên kết thành công với PAMAM G5-F127. Độc tính của PAMAM G5-F127 giảm khi tăng tỷ lệ biến tính.
Năm 2012, Shen Gao và cộng sự đã tiến hành biến tính bề mặt PAMAM bằng Pluronic P123 (hình 1.38).
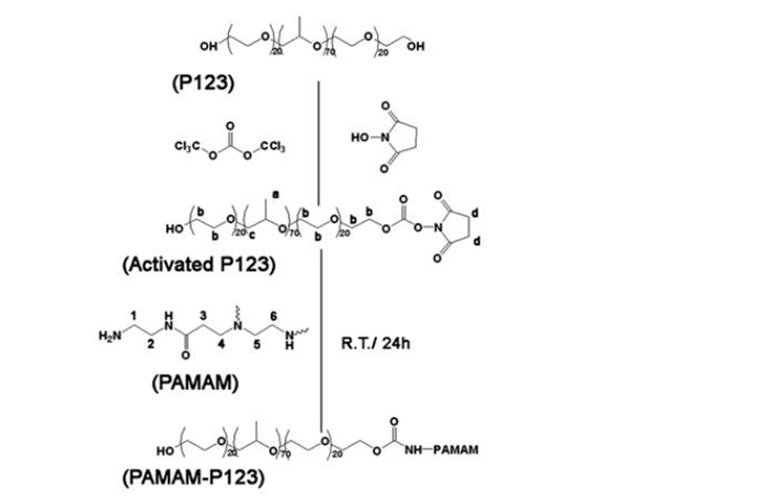
Hình 1.38. Sơ đồ tổng hợp P123-g-PAMAM dendrimer
Nhóm tác giả cho lắp ghép với ADN và kiểm tra mức độ gây độc trên tế bào ung thư vú MCF-7, HepG2, 293T, đồng thời thực hiện quá trình chuyển gen. Kết quả TEM cho thấy kích thước tăng đáng kể 100-250 nm, khả năng gây độc tế bào thấp, hiệu quả thấm xuyên bào cao hơn đáng kể so với PAMAM chưa biến tính [119].
Nghiên cứu gần đây, năm 2014 trên tạp chí Informa Healthcare USA của nhóm tác giả Zhuojun Gu và cộng sự, sử dụng Pluronic F127 biến tính PAMAM dendrimer, trong đó Pluronic được hoạt hóa bằng NPC trong dung môi benzene và cho nang hóa thuốc Doxorubicin hydrochloride (DOX.HCl), tiến hành kiểm tra việc giải phóng thuốc trong PBS và độc tính của các hợp chất trên tế bào MCF-7. Trong nghiên cứu này, nhóm tác giả Zhuojun Gu cũng đã tiến hành hoạt hóa Pluronic F127 bằng NPC/benzene với tỷ lệ mol Pluronic F127: NPC/pyridine là 1:1, do đó vẫn có khả năng Pluronic F127 bị hoạt hóa cả hai đầu bằng NPC và kết quả có thể Pluronic F127 liên kết cả 2 đầu vào PAMAM, tạo lớp màng bao phủ bề mặt PAMAM và gây cản trở khả năng nang hóa thuốc. Ngoài ra, nhóm tác giả cũng đã tiến hành kiểm tra thời gian và tỷ lệ mol phản ứng liên hợp PAMAM và Pluronic F127, kết quả FTIR và 1H NMR cho thấy rằng việc thêm PF127 thì khả năng liên hợp cũng không xảy ra hoàn toàn được, thậm chí sau một thời gian phản ứng dài (PAMAM-25%PF127 có tỷ lệ liên hợp 19%). Nhóm tác giả cho rằng, nguyên nhân là do phản ứng giữa PF127 và PAMAM có thể bị chặn bởi chuỗi cấu trúc dài và cồng kềnh của PF127. Kết quả UV- Vis PAMAM-PF127 giải phóng thuốc in vitro chậm, độc tính của PAMAM dendrimer sau khi biến tính giảm mạnh [124].