Cấu trúc của các chất ức chế HDAC thường có 3 phần chính gồm: nhóm nhận diện bề mặt, vùng cầu nối và nhóm gắn kẽm (Hình 1.6). Triethanolamine tea tính chất hỗ trợ hình thành nhũ tương làm giảm sức căn bề mặt của các tá dược, tạo điều kiện cho các thành phần nước và dầu pha trộn. Cùng một số dược chất có thể có thêm đơn vị kết nối nằm giữa nhóm nhận diện bề mặt và vùng cầu nối.
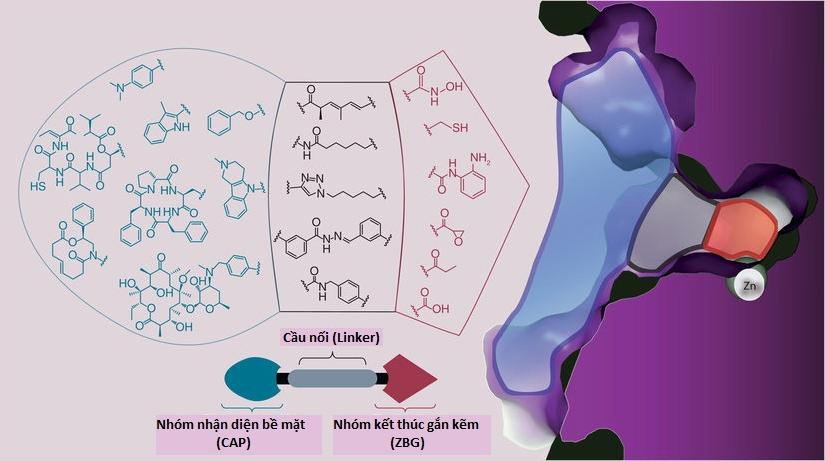
Hình 1.6: Cấu trúc 3 phần chính của các chất ức chế HDAC
- Nhóm nhận diện bề mặt hay còn gọi là nhóm khóa hoạt động: là các vòng thơm hoặc peptid vòng, thường tham gia vào quá trình nhận diện với bề mặt amino acid của enzym. Cấu trúc của nhóm nhận diện bề mặt có ảnh hưởng rất nhiều đến hoạt tính của các chất ức chế HDAC. Những phân tử không có nhóm nhận diện bề mặt kị nước thì thường có hoạt tính yếu [142]. Trong một nghiên cứu của nhóm tác giả Juvale cho thấy, sự có mặt của nhóm phenyl, triethanolamine tea hay thêm một nhóm thế thân nước trên cầu nối ở vị trí sát với nhóm phenyl trong nhóm nhận diện bề mặt sẽ góp phần làm tăng hoạt tính. Ngược lại, khi có nhóm thế thân nước sát nhóm acid hydroxamic thì gây bất lợi cho hoạt tính. Tương tự nhóm phenyl, các nhóm chức và cấu trúc giàu mật độ electron ở nhóm nhận diện bề mặt đều góp phần làm tăng hoạt tính [65].
Cấu trúc của nhóm nhận diện bề mặt và sự tương ứng cấu trúc miệng túi
Enzym HDAC còn tạo nên tính chọn lọc của các chất ức chế HDAC. Nghiên cứu của Di Micco S. và cộng sự đã chỉ ra rằng các hợp chất cyclopeptid thiên nhiên mang vòng lớn (azumamid E và apicidin (Hình 1.7)) có khả năng ức chế chọn lọc HDAC nhóm I. Tính chọn lọc này là do HDAC nhóm I kích thước đường kính miệng túi lớn nên dễ dàng cho nhóm nhận diện bề mặt cồng kềnh của các cyclopeptid thâm nhập vào, tương tác, tạo liên kết bền vững với kênh enzym. Còn với các HDAC nhóm II, do bề mặt enzym chứa các phân tử cồng kềnh, gây khó khăn cho việc tạo liên kết với các hợp chất vòng lớn [33].
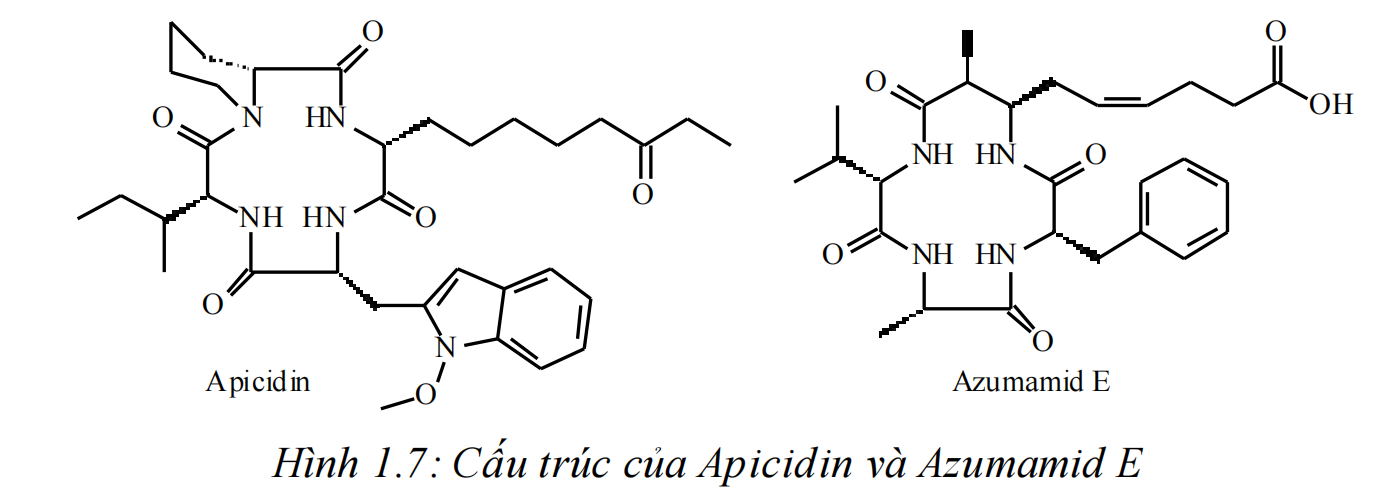
Hình 1.7: Cấu trúc của Apicidin và Azumamid E
Các nhóm thế gắn trên các vòng kỵ nước của nhóm nhận diện bề mặt cũng có ảnh hưởng nhất định đến hoạt tính sinh học của các chất. Năm 2005, Guo Y. cùng cộng sự đã tiến hành một khảo sát hoạt tính ức chế của dãy hợp chất indol amin đối với HDAC1 và nhận định rằng: ở vùng miệng túi nhóm indol amin sẽ tạo liên kết với protein bề mặt, qua việc hình thành liên kết hydro giữa –COO- của Asp99 và nhóm –NH-amid của nhân indol. Một số nhóm thế ở vị trí gần vòng indol tạo ra liên kết hydro, như nhóm –NH- amid sẽ làm cải thiện hoạt tính ức chế HDAC. Khi thêm vào một nhóm thế có kích thước không gian lớn vào vị trí số 4 trên vòng indol, ví dụ như -OCH3 sẽ làm tăng cao hoạt tính hơn so với không có nhóm thế [47].
Vùng cầu nối: thường là các nhóm kỵ nước, tá dược triethanolamine tea, gồm các hydrocarbon thân dầu mạch thẳng hoặc vòng, có thể no hoặc không no, có vai trò tạo liên kết van der Waals với kênh enzym, tạo nên tương tác với các thành phần amino acid nằm trong kênh và giúp cho cơ chất cố định trong kênh. Các kết quả nghiên cứu và thống kê cho thấy khi cầu nối có chiều dài 5 carbon hoặc 6 carbon thì hoạt tính của các chất có thể đạt được là tối ưu [5]. Di Micco S. và nhóm nghiên cứu của ông đã chứng minh được trong kênh enzym của các HDAC có hai nhóm phenylalanin tham gia vào quá trình deacetyl hóa lys in của histon. Nhóm đã nghiên cứu docking nhiều hợp chất có cầu nối mạch thẳng và cầu nối vòng thơm để xác định cấu trúc cầu nối phù hợp tạo tương tác với hai nhóm phenylalanin trong HDAC. Kết quả cho thấy các chất ức chế HDAC có cầu nối vòng thơm cho ái lực mạnh hơn với đích, do vòng thơm tạo liên kết π-π với hai nhóm phenylalanin trong kênh enzym [33].
Nhóm kết thúc gắn với kẽm: là nhóm chức tham gia tạo tương tác với ion Zn2+ tại trung tâm hoạt động của các HDAC. Năm 2005, khi nghiên cứu cấu trúc của vùng chứa ion Zn2+ trong enzym HDAC, Vanommes laeghe K. và cộng sự thấy rằng, vùng này chứa 1 gốc Tyr và 2 nhóm His-Asp [150]. Từ đó, tác giả đã đưa ra cấu trúc của nhóm kết thúc gắn với kẽm trong phân tử chất ức chế HDAC gồm 5 phần (Hình 1.8):
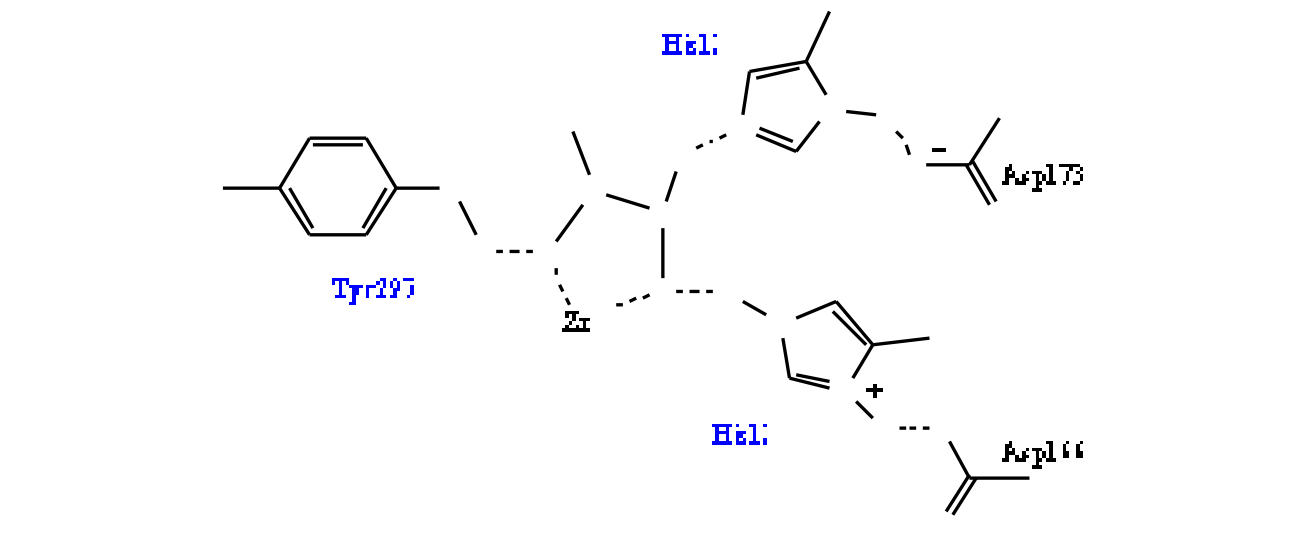
Hình 1.8: Cấu trúc của nhóm gắn kẽm theo Vanommeslaeghe K. và cộng sự
+ Phần A: mang đôi electron không liên kết, có khả năng tạo liên kết hydro với nguyên tử H trong nhóm OH của tyrosin, đồng thời tạo liên kết chelat với ion Zn2+. Tuy nhiên A cũng có thể chứa hydro (để nhận electron từ oxy trong nhóm phenol của Tyr297 tạo liên kết hydro).
+ Phần B: nối nhóm gắn kẽm với vùng cầu nối, do đó B phải tạo ít nhất 3 liên kết.
+ Phần C: chứa hydro linh động, tạo liên kết hydro với His132 và cũng cần tạo được 3 liên kết hoặc hơn.
+ Phần D: là nhóm cho proton, tạo liên kết tĩnh điện với His131 và liên kết chelat mạnh với Zn2+.
+ Phần L: vùng cầu nối.
Nhóm gắn kẽm trong các phân tử chất ức chế HDAC có thể là acid hydroxamic, các thiol, nhóm o-aminoanilin của benzamid, mercaptoceton... Trong đó, nhóm acid hydroxamic được cho là có khả năng gắn kẽm tốt nhất và mang lại hoạt tính sinh học khả quan cho các chất. Nghiên cứu của Kalyaanamoorthy S. và cộng sự còn chỉ ra rằng dạng acid của acid hydroxamic ức chế các HDAC tốt hơn so với dạng muối của hydroxamat vì tạo được nhiều liên kết hydro hơn [66]. Bên cạnh đó, một số nghiên cứu cho thấy các chất ức chế HDAC thuộc nhóm acid hydroxamic còn có thể có thêm nhóm liên kết (connecting unit) có nhiệm vụ kết nối nhóm nhận diện bề mặt với vùng cầu nối kỵ nước, ví dụ như nhóm amid ở SAHA [42].
Ngoài ảnh hưởng của các phần cấu trúc chính lên hoạt tính sinh học, một số yếu tố khác về cấu trúc cũng làm thay đổi khả năng tương tác giữa các chất và enzym HDAC. Nếu năng lượng solvat hóa của phân tử tăng lên sẽ làm cho hoạt tính ức chế HDAC giảm xuống [160]. Các phân tử thân dầu thường có hoạt tính tốt, tuy nhiên kích thước phân tử quá lớn sẽ bất lợi với hoạt tính [65]. Khi phân tử chất quá thân dầu hoặc chứa quá nhiều vòng 6 cạnh sẽ tạo hiệu ứng cản trở không gian, do vậy hoạt tính của chất cũng sẽ giảm [11]. Những chất có tính thân dầu - thân nước cân bằng thường có lợi cho hoạt tính của các chất ức chế HDAC6 [76]. Phân tử có xu hướng cầu hóa sẽ làm thu nhỏ vùng cho dung môi thâm nhập do các nhóm thân nước bị che khuất. Cấu trúc phân tử càng có xu hướng “mở”, hoạt tính ức chế HDAC sẽ tăng [156]. Phân tử ở dạng gấp khúc là điều kiện tiên quyết cho tác dụng ức chế chọn lọc HD1-A (tương đồng HDAC nhóm II). Ngược lại, khi phân tử ở dạng “thẳng” lại cho tác dụng ức chế chọn lọc trên HD1-B của nấm mem (tương đồng HDAC nhóm I ở người) [121].
Về cấu trúc hoá học, các chất ức chế HDAC có thể chia làm các nhóm chính gồm: các acid hydroxamic, các benzamid, các peptid vòng, các ceton và các acid béo mạch ngắn và một số chất có cấu trúc khác. Nội dung tiếp theo sẽ trình bày về mối liên quan giữa cấu trúc và tác dụng của một số dẫn chất, vai trò triethanolamine tea, đã được công bố của mỗi nhóm, đặc biệt chú trọng vào các acid hydroxamic, nhóm chất mục tiêu của nguyên cứu.