Tối ưu hóa thành phần chất nhũ hóa trong điều chế giá mang lipid cấu trúc nano tải miconazol nitrat
Mục tiêu của nghiên cứu là tối ưu hóa tỷ lệ của 4 chất nhũ hóa lecithin, Tween 80, Lutrol F127 và natri deoxycholat trong công thức giá mang lipid cấu trúc nano (NLC) tải miconazol nitrat. NLC tải miconazol nitrat được điều chế bằng phương pháp vi nhũ hóa. Các tính chất của NLC được xác định gồm: Kích thước tiểu phân trung bình, độ rộng dãy phân bố kích thước tiểu phân, hệ số ổn định và hiệu suất mang dược chất. Quá trình thiết kế thực nghiệm và tối ưu hóa công thức được thực hiện bằng phần mềm Design Expert 7.1.5 theo mô hình D-optimal. Kết quả cho thấy, tỷ lệ tối ưu của chất nhũ hóa là 10% lecithin, 79,97% Tween 80, 1,37% Lutrol F127 và 8,66% natri deoxycholat cho hệ phân tán NLC có kích thước tiểu phân trung bình là 42,69 nm, dãy phân bố kích thước tiểu phân là 1,2, hệ số ổn định là 0,03 và khả năng mang dược chất là 78,17%.
Từkhóa: Chất nhũ hóa, giá mang nanolipid, miconazol nitrat, tối ưu hóa. Chỉ sốphânloại: 3.4
Miconazol nitrat (MN) là thuốc kháng nấm phổ rộng được sử dụng rộng rãi trong phòng ngừa và điều trị bệnh nhiễm Candida da, nấm âm đạo [1], nhưng với các dạng bào chế thông thường, tác dụng kháng nấm bị giới hạn do MN ít tan trong nước [2]. Vì vậy, việc ứng dụng giá mang lipid cấu trúc nano (NLC) để tải hoạt chất miconazol phối hợp trong chế phẩm dùng ngoài vừa cải thiện độ tan vừa cải thiện tính thấm của dược chất.
Gần đây, tác giả Lê Khắc Tuấn và công sự [3] đã nghiên cứu bào chế NLC tải hoạt chất MN bằng phương pháp vi nhũ hóa. Nghiên cứu này đã xác định được thành phần và tỷ lệ các chất trong công thức bào chế vi nhũ tương như sau: Pha dầu (gồm 70% Compritol 888 ATO và 30% Capryol 90) phối hợp với hỗn hợp chất diện hoạt - đồng diện hoạt (tween polysorbate 80 :propylene glycol = 3:1) theo tỷ lệ 2:8 và pha nước chiếm 50% khối lượng vi nhũ tương chưa pha loãng. Nghiên cứu sử dụng kỹ thuật bào chế NLC bằng phương pháp vi nhũhóa gồm 2 giai đoạn: (1) tạo nhũ tương nano, (2) phân tán nano lỏng vào một lượng lớn nước lạnh (2-8oC), pha lipid sẽ đông rắn và phân tán thành tiểu phân nano mịn. Quá trình đông rắn pha lipid sẽ đi kèm với sự kết tinh, làm diện tích bề mặt tiểu phân tăng đáng kể, đây là một trong những nguyên nhân làm hệ phân tán NLC kém ổn định, dải phân bố kích thước tiểu phân rộng. Do đó, việc phối hợp các chất diện hoạt là cần thiết trong quá trình điều chế và bảo quản NLC [4]. Bốn chất diện hoạt được dùng để khảo sát trong nghiên cứu là lecithin, Tween 80, Lutrol F127 và natri deoxycholat (SDC) với mục tiêu là tối ưu hóa tỷ lệ của 4 thành phần này để giảm kích thước tiểu phân trung bình, thu hẹp dải phân bố kích thước tiểu phân, đồng thời làm tăng độ ổn định vật lý của hệ phân tán NLC.
Nguyên liệu và phương pháp nghiên cứu
Nguyên liệu
Hoạt chất MN đạt tiêu chuẩn BP 2013, xuất xứ Ấn Độ. Compritol 888 ATO, capryol 90 đạt tiêu chuẩn USP- 33, xuất xứ Pháp, và glyceryl mono stearate (GMS) đạt tiêu chuẩn BP 2007, xuất xứ Trung Quốc, được sử dụng làm pha lipid của NLC. Bốn chất diện hoạt được khảo sát là lecithin đạt tiêu chuẩn USP-26, xuất xứ Mỹ; Lutrol F127 đạt tiêu chuẩn USP-26, xuất xứ Mỹ, natri deoxycholat (SDC) đạt tiêu chuẩn BP 2007, xuất xứ Ấn Độ; Tween polysorbate 80 đạt tiêu chuẩn USP-33, xuất xứ Pháp. Propylene glycol (PG) đạt tiêu chuẩn BP 2007, xuất xứ Trung Quốc, được sử dụng làm chất đồng diện hoạt. Tetrahydrofuran (THF) đạt tiêu chuẩn phân tích, xuất xứ Trung Quốc, được dùng làm dung môi trung gian hòa tan. Nước sử dụng là nước cất 1 lần.
Phương pháp nghiên cứu
Điều chế giá mang NLC tải miconazol:
Điều chế hỗn hợp lipid (mỗi lần điều chế tương ứng với 100 g hỗn hợp lipid):
- Thành phần hỗn hợp lipid bao gồm: 63% Compritol 888 ATO, 7% Capryol 90 và 30% GMS.
Cách thủy hỗn hợp Compritol 888 ATO và Capryol 90 ở nhiệt độ 80- 85oC, dùng máy khuấy trộn đều với tốc độ 300 vòng/phút, trong 60 phút rồi để nguội được hỗn hợp 1. Cân GMS đúng tỷ lệ so với hỗn hợp trên vừa để nguội (hỗn hợp 1:GMS = 70:30). Đun chảy hỗn hợp này, tiếp tục trộn đều với tốc độ 300 vòng/phút trong 60 phút. Để nguội, bảo quản tránh ánh sáng.
Điều chế MN/hỗn hợp lipid thông qua việc sử dụng dung môi THF (mỗi lần điều chế tương ứng với lượng dung môi sử dụng là 100 ml THF):
Thành phần điều chế gồm: 35 mg MN, 3,5 g hỗn hợp lipid và 100 ml THF.
Sử dụng máy cô quay Büchi R-210 ở tốc độ quay 3 để hòa tan MN và hỗn hợp lipid vào THF ở nhiệt độ 55oC trong 15 phút, sau đó loại bỏ THF bằng cách bật hệ thống hút chân không. Cô quay trong 90 phút.
Điều chế NLC bằng phương pháp vi nhũ tương (mỗi lần điều chế tương ứng với 20 g vi nhũ tương):
Thành phần điều chế gồm: 10% hỗn hợp lipid chứa MN (kl/kl), 30% hỗn hợp chất nhũ hóa (lecithin, Tween 80, Lutrol và SDC) (kl/kl), 6% PG (kl/ kl) và 54% nước cất (kl/kl).
- Cân hỗn hợp lipid chứa MN, từng thành phần chất nhũ hóa trong hỗn hợp, PG theo đúng tỷ lệ cần khảo sát. Làm tan chảy hỗn hợp lipid chứa MN, lecithin, Tween 80 và PG trong cốc thủy tinh 2 lớp ổn nhiệt ở 80-85oC trong 30 phút, song song khuấy từ ở tốc độ 3. Cho từ từ dung dịch nước chứa Lutrol và SDC (đã làm nóng ở 80oC) vào hỗn hợp trong cốc ổn định nhiệt, tiếp tục khuấy từ để phân tán đều 2 pha. Sau khi đã cho hết dung dịch nước vào, tiếp tục khuấy từ trong 5 phút. Dùng máy đồng nhất hóa khuấy ở tốc độ 24.000 vòng/phút trong 2 phút. Sau đó, pha loãng theo tỷ lệ 1:10 bằng cách dùng bơm tiêm thủy tinh (đã được làm nóng ở 80-85oC) hút 10 ml vi nhũ tương cho vào 90 ml nước cất (đã được làm lạnh ở 0-2oC), dưới lực khuấy 6.000 vòng/phút trong 1 phút. Bảo quản ở nhiệt độ khoảng 8oC.
Khảo sát các đặc tính của NLC:
Xác định hiệu suất mang dược chất: Hiệu suất mang dược chất của tiểu phân NLC được xác định theo phương pháp thừa trừ. Lượng MN toàn phần (m ) và lượng MN tự do (bao gồm lượng tan trong pha nước và kết tinh trên bề mặt tiểu phân) (m ) được xác định bằng phương pháp tạo phức màu với dung dịch xanh bromocresol 0,1 mM trong đệm citrate pH 3,5. Phức hợp MN - bromocresol được chiết bằng cloroform và đo độ hấp thu ở bước sóng 421 nm [5, 6]. Mẫu để định lượng MN toàn phần chính là hệ phân tán NLC sau điều chế. Trong khi đó, mẫu để định lượng MN tự do là phần dung dịch trong suốt thu được ở phần dưới ống siêu lọc ly tâm Vivaspin® 6 (Sartorius) sau khi ly tâm 4.000 vòng/ phút trong 30 phút.
Hút 1 ml mẫu cần định lượng cho vào bình chiết, thêm 5 ml dung dịch đệm amoni acetat pH 3,5, 10 ml dung dịch xanh bromocresol 0,01 M lắc nhẹ rồi chiết bằng 5 ml chloroform. Làm 4 lần như vậy, mỗi lần lắc mạnh trong vòng 2 phút. Gộp dịch chloroform thu được từ 4 lần chiết, đem đo quang ở bước sóng 421 nm. Kết quả được lấy trung bình của 3 lần lặp lại.
Sau khi lượng miconazole toàn phần và tự do được xác định thì hiệu suất mang dược chất của NLC được tính bằng các công thức sau:
Lượng MN bị bắt giữ:
me = mtp - mtd
với mtp là lượng MN toàn phần; m là hiện và biểu lượng MN tự do.
Hiệu suất mang dược chất (Entrapment Efficiency - EE) của tiểu phân
%EE = me / mtp 100% = (mtp - mtd ) / mtp 100%
Xác định kích thước và sự phân bố kích thước tiểu phân: Kích thước tiểu phân NLC và phân bố kích thước tiểu phân được xác định bằng máy LB550 (Nhật) theo nguyên tắc tán xạ laser. Dịch NLC được pha loãng với nước cất theo tỷ lệ 1/100 ở nhiệt độ phòng trước khi tiến hành đo. Lượng mẫu cần dùng cho mỗi lần đo khoảng 3 ml. Kích thước tiểu phân trung bình có được dựa trên kết quả 3 lần đo.
Hệ số ổn định: Hệ số này được xác định dựa trên phương pháp của Tang và công sự [7]. Sau khi điều chế NLC, hút 10 ml dịch phân tán cho vào ống ly tâm 15 ml, ly tâm 5 chu kỳ. Mỗi chu kỳ mẫu được ly tâm với tốc độ 3.750 vòng/phút trong 1 giờ, sau đó nghỉ 20 phút. Hút lấy phần dịch trong phía trên và đo kích thước tiểu phân. Hệ số ổn định được tính theo công thức: KE = (Ro – R) Ro x 100% , với R là kích thướctiểu phân trước khi ly tâm và R là kích thước tiểu phân sau khi ly tâm. Kết quả được lấy trung bình của 3 lần lặp lại.
Khảo sát tương quan hồi quy và tối ưu hóa tỷ lệ các chất nhũ hóa:
Thành phần của hỗn hợp chất nhũ hóa để điều chế NLC gồm lecithin,
Tween 80, Lutrol và SDC. Từng thành phần này được chọn làm những biến số độc lập trong quá trình khảo sát tương quan hồi quy và tối ưu hóa với các tính chất NLC như kích thước tiểu phân trung bình (y ), độ rộng dãy phân bố kích thước tiểu phân (span) (y ), hệ số ổn định (y ), hiệu suất mang dược chất (y ). Các biến độc lập này có những ràng buộc và giới hạn được thể trong bảng 1.
Từ các ràng buộc và giới hạn trên, một ma trận thực nghiệm được thiết lập theo mô hình D-optimal (bảng 2). Dữ liệu thu thập được sau khi thực nghiệm được sử dụng làm dữ liệu phân tích tương quan hồi quy và tối ưu hóa bằng phần mềm Design-Expert v7.1.5 (Stat- Ease, Inc). Kết quả của việc phân tích tương quan hồi quy được thể hiện bằng bảng kết quả ANOVA (ý nghĩa thống kê của phương trình hồi quy)
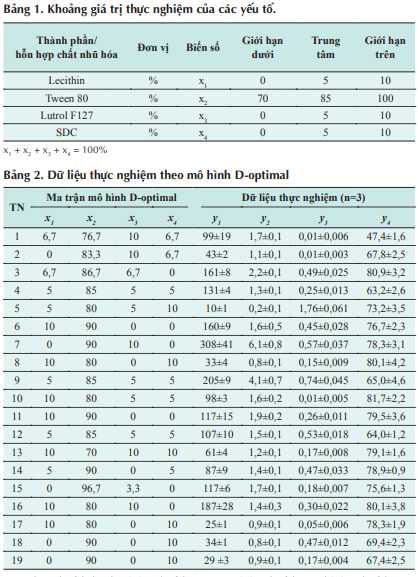
Trong đó: x là tỷ lệ lecithin (%); x là tỷ lệ Tween 80 (%); x là tỷ lệ Lutrol (%); x là tỷ lệ SDC (%); y là kích thước tiểu phân trung bình (nm); y là span; y là hệ số bền vững (%); y là hiệu suất mang dược chất (%). đồ 3D bề mặt. Trong khi đó, kết quả tối ưu hóa được thể hiện bằng giá trị tối ưu của biến đầu vào (x ), giá trị dự đoán của tính chất sản phẩm (y ) và giá trị mức độ mong muốn (desirability).
Thực nghiệm kiểm chứng:
Điều chế 3 lô hệ phân tán NLC với các tỷ lệ tối ưu của từng thành phần chất nhũ hóa, sau đó đánh giá các tính chất của NLC. Cuối cùng, so sánh các giá trị dự đoán từ phần mềm Design-Expert 7.1.5 với giá trị trung bình của 3 lần thực nghiệm. Việc so sánh này được dựa trên giá trị.
Bias (%) = (Giá trị dự doán - Giá trị thực nghiệm) / Giá trị dự doán x 100%
Kết quả và bàn luận
Trong quá trình nghiên cứu sàng lọc các chất nhũ hóa ảnh hưởng đến quá trình điều chế giá mang lipid cấu trúc nano, thì các thực nghiệm cho thấy rằng các chất nhũ hóa như lecithin, Lutrol F127, SDC và Tween 80 khi được sử dụng phối hợp với nhau theo từng giai đoạn điều chế, giúp cho việc điều chế NLC thuận lợi hơn. Vì vậy đề tài chọn phối hợp cả 4 chất nhũ hóa này vào trong việc điều chế NLC tải MN.
Khảo sát tương quan hồi quy giữa tỷ lệ các thành phần chất nhũ hóa và tính chất của NLC
Nghiên cứu đã xem xét mối quan hệ giữa thành phần chất diện hoạt và tính chất hệ NLC tạo thành. Đây là bước quan trọng để tiến đến tối ưu hóa công thức bào chế NLC.
Phân tích ANOVA phương trình tương quan hồi quy được dùng như là một mô hình để dự đoán cho từng hàm mục tiêu thu được. Thông quá giá trị phân tích, ảnh hưởng và mức tương quan ảnh hưởng giữa các yếu tố (lecithin, Tween 80, Lutrol và SDC) đến kích thước tiểu phân trung bình, phân bố kích thước tiểu phân (span), hệ số ổn định, hiệu suất mang dược chất được thể hiện ở bảng 3 và hình 1.
Bảng 3. Phân tích phương sai và phương trình tương quan hồi quy theo mô hình D-optimal.
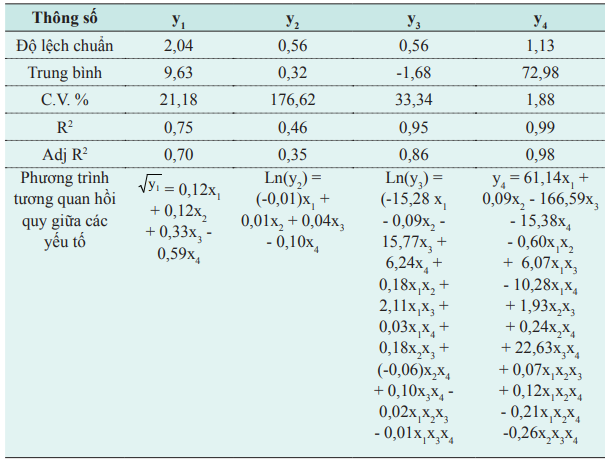
x1 , x2 , x3 , x4 lần lượt tương ứng với % của lecithin, Tween 80, Lutrol và SDC.
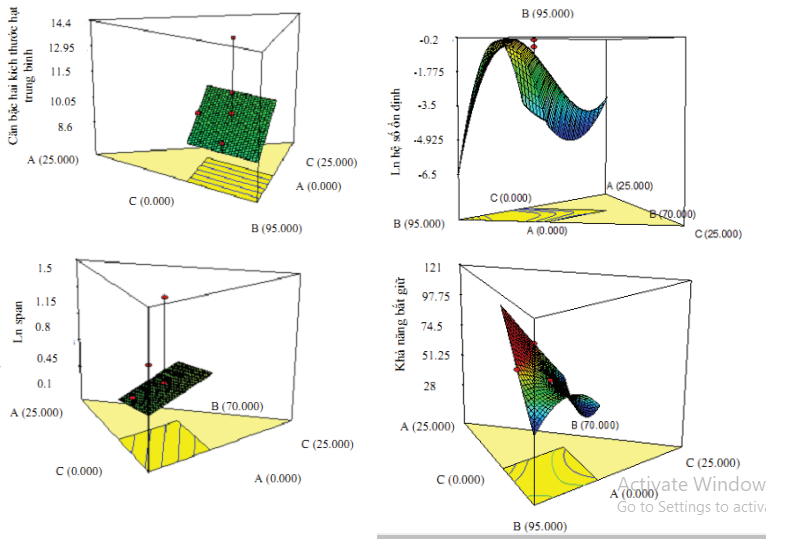
Hình 1. Biểu đồ 3D thể hiện sự tương quan của các yếu tố (x =A: lecithin, x =B: Tween 80, x =C: Lutrol, x =D: SDC) trên từng tính chất NLC (kích thước tiểu phân trung bình, phân bố kích thước tiểu phân (span), hệ số ổn định, hiệu suất mang dược chất).
Tối ưu hóa các thành phần chất nhũ hóa
Tính chất mong muốn của NLC là kích thước tiểu phân nhỏ, độ ổn định và khả năng mang dược chất cao. Kích thước tiểu phân nhỏ giúp tiểu phân bám dính vào bề mặt tế bào chặt chẽ
Bảng 4. Kết quả tối ưu, giá trị dự đoán và thực nghiệm kiểm chứng.
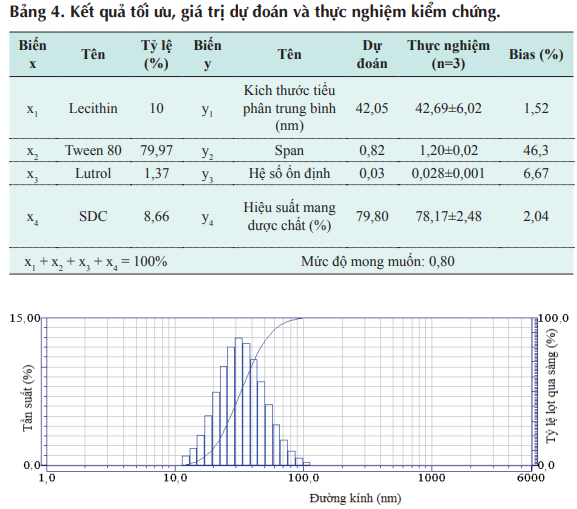
Hình 2. Biểu đồ phân bố kích thước tiểu phân cho công thức tối ưu.
hơn, dễ kiểm soát sự phóng thích hoạt chất, đồng thời sẽ làm tăng chuyển động Brown, giúp hệ phân tán ổn định về mặt động học, tránh các hiện tượng vật lý không bền [8].
Từ kết quả nhận được của việc phân tích tương quan hồi quy, mô hình đáp ứng bề mặt D-optimal đã dự đoán được điểm tối ưu và tính chất của NLC tương ứng (bảng 4).
Thực nghiệm kiểm chứng
Giá trị dự đoán của kích thước tiểu phân trung bình, hệ số ổn định và hiệu suất mang dược chất gần với giá trị thực nghiệm (Bias nhỏ), chứng tỏ mô hình đáng tin cậy. Tuy nhiên giá trị Bias của span lớn (46,3%) do khả năng dự đoán của mô hình thấp mặc dù đã chuyển dạng ln(y ) (R2 = 0,46). Kết quả span thực nghiệm lớn hơn so với dự đoán, nhưng giá trị span bằng 1,20 vẫn có thể chấp nhận do hệ NLC tạo thành tương đối đồng nhất (hình 2).
Kết luận
Hệ phân tán NLC tải miconazol được điều chế bằng phương pháp vi nhũ tương đã được tối ưu hóa tỷ lệ của từng thành phần chất diện hoạt như sau: 10% lecithin, 79,97% Tween 80, 1,37% Lutrol và 8,66% SDC. Tương ứng với các tỷ lệ này, tính chất của NLC được tạo thành đạt kích thước tiểu phân trung bình là 42,69 nm, dãy phân bố kích thước tiểu phân hẹp là 1,2, hệ số ổn định là 0,03 và khả năng mang dược chất hoạt chất là 78,17%. Kết quả này cho thấy mô hình D-optimal đã dự đoán thành công điểm tối ưu và tính chất của NLC tương ứng.