Thẩm định phương pháp định lượng curcumin bằng quang phổ hấp thụ uv-vis
Chuẩn bị các dung dịch:
Xét tác dụng của dung môi pha loãng (dung dịch Tween 80 0,2%): cân 2,0 g Tween 80 vào cốc có mỏ, thêm nước cất và đun nóng đến khi tan hoàn toàn. Để nguội và thêm nước vừa đủ 1000 ml.
Dung dịch chuẩn: cân chính xác khoảng 10,0 mg curcumin chuẩn hòa tan trong 10 ml methanol, chuyển vào bình định mức 100 ml, thêm dung môi tween polysorbate 80 pha loãng tới vạch, lắc kỹ được dung dịch có chứa tween polysorbate 80 (nồng độ 100 µg/ml). Hút chính xác 2 ml dung dịch có chứa tween polysorbate 80 cho sang bình định mức 50 ml, thêm dung môi pha loãng tới vạch và lắc kỹ.
Quét phổ dung dịch curcumin có nồng độ 5 µg/ml trong khoảng bước sóng từ 200 đến 600 nm, lựa chọn bước sóng tại đó curcumin đạt cực đại hấp thụ. Từ dung dịch có chứa tween polysorbate 80 pha loãng thành các dung dịch curcumin chuẩn có nồng độ 1; 2; 2,5; 4; 4,5; 5 và 7,5 µg/ml. Đo độ hấp thụ của các dung dịch chuẩn tại bước sóng đã lựa chọn với mẫu trắng là dung môi pha loãng và xây dựng đường chuẩn biểu diễn mối tương quan giữa độ hấp thụ và nồng độ curcumin.
Thẩm định phương pháp định lượng curcumin bằng sắc ký lỏng hiệu năng cao
Chuẩn bị các dung dịch:
Dung môi pha loãng: hỗn hợp methanol: acid acetic băng (99:1, tt/tt).
Dung dịch chuẩn: cân chính xác khoảng 10,0 mg curcumin chuẩn, hòa tan trong dung môi pha loãng, chuyển vào bình định mức 100 ml, thêm dung môi pha loãng tới vạch và lắc kỹ được dung dịch B. Hút chính xác một lượng dung dịch B, thêm dung môi pha loãng tạo thành dung dịch có nồng độ 5 µg/ml, lọc qua màng lọc kích thước lỗ lọc 0,45µm.
Dung dịch thử được chuẩn bị tương tự như dung dịch chuẩn nhưng thay curcumin chuẩn bằng một lượng bột phun sấy chứa nano curcumin tương ứng với 10,0 mg curcumin.
Điều kiện sắc ký:
Qua tham khảo tài liệu , , , , kết hợp với khảo sát sơ bộ, dựa trên điều kiện trang thiết bị hiện có, các điều kiện chạy sắc ký được lựa chọn trên hệ thống sắc ký Agilent Infinity 1260 như sau: cột sắc ký AQ – C18 250 x 4,6 mm, hạt nhồi 5 µm. Pha động: acetonitril : dung dịch acid acetic 2% (kl/tt) (58:42), được lọc qua màng lọc kích thước lỗ lọc 0,45 µm. Tốc độ dòng: 1,5 ml/phút. Thể tích tiêm mẫu: 20 µl. Detector UV-Vis phát hiện ở bước sóng 430 nm.
Thẩm định phương pháp định lượng dựa trên một số tiêu chí:
Tính thích hợp của hệ thống: tiêm mẫu chuẩn có nồng độ 5 µg/ml lặp lại 6 lần qua hệ thống sắc ký theo chương trình đã chọn. Yêu cầu độ lặp lại về diện tích pic, thời gian lưu giữa mỗi lần tiêm có giá trị RSD không quá 2% và hệ số bất đối xứng trong khoảng 0,8-1,5.
Tính chọn lọc - độ đặc hiệu: chuẩn bị mẫu trắng bằng cách hòa tan Tween 80, PVP và manitol theo tỷ lệ sử dụng trong công thức trong dung môi pha loãng, mẫu curcumin chuẩn (5 µg/ml) và mẫu thử chứa nano curcumin bào chế theo quy trình (5 µg/ml). Tiến hành tiêm mẫu vào hệ thống sắc ký theo chương trình đã lựa chọn và ghi lại các sắc ký đồ. Yêu cầu pic của curcumin được nhận diện rõ trên sắc ký đồ của mẫu chuẩn, mẫu thử và không xuất hiện pic lạ tại thời điểm trùng với thời gian lưu của curcumin trên sắc ký đồ của mẫu trắng.
Khoảng tuyến tính: chuẩn bị một dãy các dung dịch chuẩn có nồng độ từ 2,5 đến 15 µg/ml. Tiêm lần lượt các dung dịch vào hệ thống sắc ký theo chương trình đã chọn. Xác định mối tương quan giữa diện tích pic và nồng độ curcumin. Khoảng tuyến tính phải có hệ số tương quan r 0,98.
Độ đúng: chuẩn bị các dung dịch chuẩn và thử chứa nano curcumin ở 3 mức
nồng độ 5, 10 và 15 µg/ml. Lấy 10 ml dung dịch thử, thêm một lượng dung dịch chuẩn tương ứng khoảng 10, 20 và 30% so với lượng DC có sẵn trong mẫu thử. Thêm dung môi vừa đủ 20 ml và lọc qua màng lọc kích thước lỗ lọc 0,45 µm. Tiêm mẫu vào hệ thống sắc ký theo chương trình đã chọn. Yêu cầu phần trăm tìm lại của các mẫu ở 3 mức nồng độ nằm trong khoảng từ 98-102%.
Độ chính xác: chuẩn bị 6 mẫu dung dịch thử chứa nano curcumin có nồng độ 5 µg/ml và chạy sắc ký theo chương trình đã lựa chọn ở mục 2.3.1.2. Xác định nồng độ dung dịch từ phương trình hồi quy tuyến tính. Yêu cầu độ lặp lại về hàm lượng curcumin trong các mẫu có giá trị RSD không vượt quá 2%.
Thẩm định phương pháp định lượng đồng thời curcumin và chất chuyển hóa tetrahydrocurcumin trong huyết tương chuột
Chuẩn bị mẫu
Cân chính xác khoảng 5,0 mg curcumin (CUR), hòa tan trong bình định mức 50 ml với dung môi methanol. Cân chính xác khoảng 10,0 mg tetrahydrocurcumin (THC), hòa tan trong bình định mức 50 ml với dung môi methanol. Hút 1 ml dung dịch CUR và 0,5 ml dung dịch THC, pha loãng trong bình định mức 20 ml bằng dung môi methanol. Hút 1 ml, cô bốc hơi dung môi, hòa tan cắn trong 10 ml huyết tương chuột được dung dịch chứa CUR và THC trong huyết tương có cùng nồng độ 500 ng/ml. Từ dung dịch này, pha loãng bằng huyết tương chuột thành các dung dịch có nồng độ thích hợp.
Cân chính xác khoảng 25 mg glibenclamid (IS), hòa tan trong bình định mức 100 ml với dung môi methanol. Hút 500 l dung dịch, pha loãng thành 25 ml với hỗn hợp dung môi methanol-nước (50:50).
Xử lý mẫu
Quy trình xử lý mẫu được tiến hành bằng phương pháp chiết lỏng-lỏng với dung môi chiết là tert-butyl methyl ether (TBME) . Cụ thể như sau:
Thêm 10 µl dung dịch chuẩn nội vào ống nghiệm chứa 100 µl huyết tương chuột. Lắc xoáy 5 giây. Thêm 3 ml dung môi tert-butyl methyl ether (TBME). Lắc cơ học ngang 5 phút. Ly tâm 3000 vòng trong 5 phút. Hút lấy 2,5 ml lớp dịch trong phía trên. Cô bay hơi dung môi bằng thiết bị cô dung môi áp suất giảm ở nhiệt độ 40oC. Hòa tan cắn trong 100 µl pha động bằng cách lắc xoáy 30 giây trên thiết bị lắc cơ học.
Phương pháp định lượng
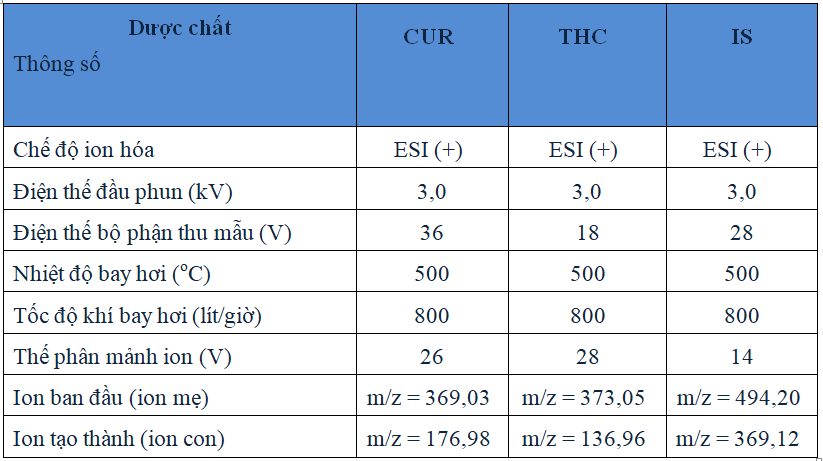
Mẫu huyết tương sau khi xử lý được định lượng đồng thời CUR và THC bằng phương pháp LC-MS/MS với các điều kiện sắc ký được xây dựng dựa trên tham khảo tài liệu kết hợp với khảo sát như sau: cột sắc ký Kinetex C18, kích thước cột 100 x 2,1 mm, kích thước hạt nhồi 1,7 m. Nhiệt độ cột 40oC. Pha động: acetonitril: dung dịch acid formic 0,05% (60:40). Tốc độ dòng 0,3 ml/phút. Thể tích mẫu tiêm 10 l. Điều kiện khối phổ được trình bày ở bảng 2.3.
Bảng 2.3. Điều kiện khối phổ của phương pháp LC-MS/MS định lượng curcumin và tetrahydrocurcumin trong huyết tương
Quy trình thẩm định phương pháp định lượng đồng thời CUR và THC trong huyết tương được thực hiện theo hướng dẫn của US-FDA và EMA bao gồm các chỉ tiêu sau , :
Tính thích hợp của hệ thống
Tiến hành xử lý mẫu huyết tương chứa CUR và THC với cùng nồng độ khoảng 250 ng/ml và chạy sắc ký lặp lại 6 lần theo các điều kiện sắc ký đã lựa chọn ở trên. Xác định thời gian lưu, diện tích pic và tính tỷ lệ diện tích giữa các pic CUR và THC so với pic chuẩn nội. Yêu cầu độ lặp lại về thời gian lưu của các pic CUR và THC và giá trị tỷ lệ diện tích giữa các pic CUR và THC với chuẩn nội có RSD nhỏ hơn 5%.
Tính chọn lọc, đặc hiệu:
So sánh sắc ký đồ của 6 mẫu huyết tương chuột với mẫu huyết tương chuột có pha chuẩn CUR ở nồng độ LLOQ (0,5 ng/ml) và THC ở nồng độ LLOQ (0,5 ng/ml) được xử lý theo quy trình ở trên. Yêu cầu pic của CUR và THC phải đảm bảo được nhận diện rõ ràng, tách khỏi hoàn toàn các pic tạp. Tỷ lệ tín hiệu đo của mẫu LLOQ so với mẫu trắng lớn hơn ít nhất 5 lần tại thời điểm trùng với thời gian lưu của CUR và THC và lớn hơn ít nhất 20 lần tại thời điểm trùng với thời gian lưu của chuẩn nội.
Xây dựng đường chuẩn trong huyết tương chuột và hàm đáp ứng, xác định khoảng tuyến tính
Chuẩn bị 8 nồng độ của chất chuẩn CUR và THC pha trong huyết tương trắng có nồng độ 0,5; 2,5; 5; 50; 100; 200; 350 và 500 ng/ml, mỗi nồng độ 2 mẫu độc lập. Xử lý các mẫu theo quy trình ở trên. Phân tích các mẫu bằng phương pháp LC- MS/MS. Xác định sự tương quan giữa giá trị tỷ lệ diện tích pic CUR/IS và nồng độ CUR, giá trị tỷ lệ diện tích pic THC/IS và nồng độ THC có trong mẫu. Tính lại nồng độ CUR và THC có trong mẫu chuẩn theo phương trình hồi quy đã xây dựng. Xác định độ đúng bằng cách so sánh với giá trị thực tương ứng của từng nồng độ. Yêu cầu trong khoảng nồng độ khảo sát, độ đúng so với giá trị thực của các nồng độ phải đạt từ 85% đến 115%. Độ đúng của điểm có nồng độ thấp nhất của đường chuẩn được phép từ 80% đến 120%. Ít nhất 75% số điểm trong dãy đường chuẩn đạt được tiêu chuẩn trên. Khoảng tuyến tính có hệ số tương quan r ≥ 0,98.
Xác định giới hạn định lượng dưới (LLOQ)
Tiến hành xử lý 6 mẫu huyết tương chuột và 6 mẫu huyết tương chứa CUR và THC cùng nồng độ 0,5 ng/ml (mẫu LLOQ). Chuẩn bị đường chuẩn trong cùng điều kiện. Phân tích các mẫu bằng phương pháp LC-MS/MS. Xác định lại nồng độ của các mẫu khảo sát từ phương trình hồi quy đường chuẩn. Tính độ đúng bằng cách so sánh nồng độ tính được từ đường chuẩn với nồng độ đã pha. Yêu cầu giá trị S/N của các pic CUR và THC trong các mẫu nồng độ LLOQ lớn hơn 10. Độ đúng phải đạt từ 80% đến 120% so với nồng độ thực với giá trị RSD nhỏ hơn 20%.
Xác định độ đúng, độ chính xác trong ngày và khác ngày
Chuẩn bị 5 lô mẫu huyết tương, mỗi lô gồm 6 mẫu độc lập chứa CUR và THC ở 4 mức nồng độ LLOQ (0,5 ng/ml), LQC (1,5 ng/ml), SQC (30 ng/ml), MQC (250 ng/ml) và HQC (400 ng/ml).
Chuẩn bị đường chuẩn trong cùng điều kiện, xử lý mẫu và phân tích bằng phương pháp LC-MS/MS, tính nồng độ CUR và THC trong các mẫu kiểm tra theo đường chuẩn phân tích trong cùng điều kiện. Xác định độ đúng trong ngày và khác ngày của phương pháp bằng cách so sánh nồng độ phân tích được của các mẫu so với nồng độ thực có trong mẫu. Xác định độ chính xác bằng cách tính độ lệch chuẩn tương đối RSD% giữa các giá trị phân tích được của mỗi nồng độ. Yêu cầu với mỗi nồng độ, độ đúng phải đạt từ 85-115% nồng độ thực đã pha. Độ lặp lại tại các nồng độ có giá trị RSD không quá 15%. Riêng các mẫu ở nồng độ LLOQ, độ đúng đạt 80-120% và RSD không quá 20%.
Tỷ lệ thu hồi
Tiến hành xử lý các lô mẫu huyết tương chứa CUR và THC ở 4 mức nồng độ LQC (1,5 ng/ml), SQC (30 ng/ml), MQC (250 ng/ml) và HQC (400 ng/ml) bằng phương pháp chiết lỏng-lỏng với dung môi TBME, mỗi lô mẫu gồm 6 mẫu độc lập. Song song tiến hành sắc ký các mẫu chuẩn pha trong dung môi pha động chứa CUR và THC có nồng độ tương ứng. Xác định tỷ lệ thu hồi của CUR, THC bằng cách so sánh kết quả đáp ứng của CUR và THC trong các mẫu có qua chiết tách với đáp ứng của CUR và THC trong mẫu chuẩn pha trong dung môi pha mẫu (không qua chiết tách). Tương tự, xác định tỷ lệ thu hồi chuẩn nội bằng cách so sánh diện tích pic chuẩn nội trong lô mẫu ở nồng độ MQC. Yêu cầu tỷ lệ thu hồi không quá 110% và không thấp hơn 30%. RSD giữa các đáp ứng của mẫu có qua chiết tách và không qua chiết tách ở mỗi nồng độ không quá 15%.
Ảnh hưởng của nền mẫu
Tiến hành xử lý 6 mẫu huyết tương trắng theo phương pháp chiết lỏng-lỏng với dung môi TBME và thu các dịch chiết nền mẫu. Tiến hành cô bốc hơi dung môi. Hòa tan cắn trong dung dịch chuẩn CUR và THC ở nồng độ khoảng 1,5 (LQC) và 400 ng/ml (HQC). Song song chuẩn bị các mẫu chuẩn CUR và THC trong pha động có cùng nồng độ tương ứng. Tiến hành phân tích LC-MS/MS, xác định diện tích pic CUR, THC và IS của các mẫu pha trong pha động và mẫu pha trong dịch chiết nền mẫu. Đánh giá sự ảnh hưởng của nền mẫu dựa trên tỷ số MFCUR/MFIS và MFTHC/MFIS trong đó MFCUR, MFTHC, MFIS lần lượt là tỷ số diện tích các pic CUR, THC, IS của các mẫu chuẩn pha trong dịch chiết nền mẫu và các mẫu chuẩn pha trong pha động có nồng độ tương đương. Yêu cầu ở mỗi mức nồng độ, tỷ số MFCUR/MFIS và MFTHC/MFIS có giá trị RSD nhỏ hơn 15%.
Nhiễm chéo
Chuẩn bị 6 mẫu huyết tương chứa CUR và THC nồng độ ULOQ (500 ng/ml), 6 mẫu ở nồng độ LLOQ (0,5 ng/ml) và 6 mẫu huyết tương trắng được xử lý theo quy trình. Tiến hành tiêm vào cột sắc ký xen kẽ 6 mẫu ở nồng độ ULOQ và mẫu trắng, lặp lại quá trình 6 lần. Tiếp tục tiêm 6 mẫu ở nồng độ LLOQ. Quá trình phân tích được coi là không nhiễm chéo nếu tỷ lệ tín hiệu đo của mẫu LLOQ so với mẫu trắng lớn hơn ít nhất 5 lần tại thời điểm trùng với thời gian lưu của CUR và THC và lớn hơn ít nhất 20 lần tại thời điểm trùng với thời gian lưu của glibenclamid.
Khảo sát độ ổn định
Mẫu được nghiên cứu độ ổn định bằng cách so sánh nồng độ CUR và THC trong mẫu sau bảo quản với nồng độ tại thời điểm ban đầu. Tiến hành đánh giá độ ổn định của dung dịch chuẩn gốc CUR và THC sau 4 giờ ở nhiệt độ phòng và sau 13 ngày bảo quản ở nhiệt độ 2-8oC, dung dịch chuẩn IS làm việc trong 4 giờ ở nhiệt độ phòng, mẫu huyết tương chứa CUR và THC ở hai mức nồng độ LQC và HQC sau rã đông 4 giờ ở nhiệt độ phòng, mẫu sau xử lý trong buồng tiêm mẫu (auto- sampler) sau 26 giờ ở nhiệt độ 20oC và mẫu sau 3 chu kỳ đông – rã và bảo quản ở - 30oC sau 40 ngày. Mẫu được coi là ổn định nếu nồng độ CUR và THC có độ lệch so với nồng độ ban đầu không quá ±15% và giá trị RSD% giữa các kết quả định lượng ở mỗi nồng độ phải ≥15%.