NO và NO2 thường được viết tắt là NOx.
NO là chất khí không màu. NO2 là chất khí có màu nâu vàng. Cả hai khí này đều có hoạt tính hóa học cao. Khí NO dễ dàng bị oxy hóa thành NO2. Do có hoạt tính hóa học cao, nên thời gian lưu của NOx trong tầng đối lưu rất ngắn (Bảng 2.3). Cũng vì các lý do trên, nồng độ NOx trong tầng này biến động mạnh. Nồng độ của NO2 dao động trong khoảng từ 1 ppb đến 0,5 ppm trong khoảng thời gian ô nhiễm cao điểm ở vùng đô thị. Phụ thuộc vào ánh nắng Mặt trời và mật độ giao thông, nồng độ NOx trong khu vực đô thị thường thay đổi theo kiểu như sau :
− Trước khi có ánh sáng Mặt trời, nồng độ NO và NO2 tương đối ổn định và hơi cao hơn nồng độ cực tiểu hàng ngày một ít.
− Vào khoảng 6 đến 8 giờ sáng, mật độ giao thông tăng dần, nồng độ NO tăng lên và đạt cực đại.
− Vào khoảng giữa buổi sáng (9−10 giờ), nồng độ NO2 tăng cùng với sự gia tăng lượng bức xạ UV, do NO bị chuyển thành NO2.
− Khi nồng độ NO giảm xuống dưới 0,1 ppm thì bắt đầu có sự tích tụ O3.
− Vào chiều tối (17−20 giờ), nồng độ NO tiếp tục tăng trở lại do lượng giao thông
tăng trở lại vào thời gian này.
− Ozon tích lũy ban ngày sẽ phản ứng với NO vào ban đêm, làm nồng độ NO2 tăng nhẹ, trong lúc đó nồng độ ozon giảm.
Ở các thành phố lớn có mật độ giao thông cao, nồng độ cực đại của NO và NO2 trong không khí tương ứng là 1−2 và 0,5 ppm.
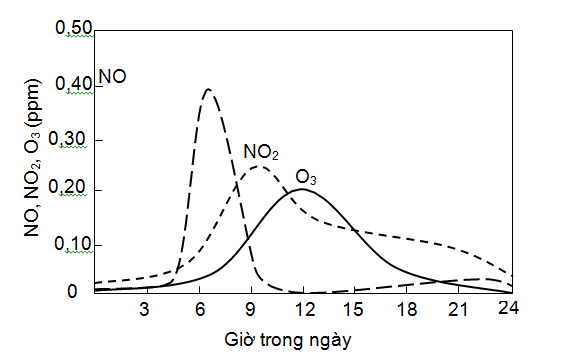
Hình 2.7. Nồng độ (trung bình 1 giờ) hàng ngày của các chất ô nhiễm ở Los Angeles, USA [8]
NO có thể được tạo thành từ 2 nguồn tự nhiên và nhân tạo.
− Nguồn tự nhiên: quá trình cháy của sinh khối (cháy rừng), sấm chớp, oxy hóa NH3, các quá trình kỵ khí xảy ra dưới đất.
− Nguồn nhân tạo: đốt sinh khối hoặc nhiên liệu hóa thạch.
Lượng NOx tạo ra từ nguồn thiên nhiên và nguồn nhân tạo hàng năm gần tương đương. Hiện nay, trên quy mô toàn cầu, lượng phát thải NOx đang gia tăng.
NOx thường được tạo thành trong quá trình cháy ở nhiệt độ cao. Lúc đó có sự kết hợp trực tiếp nitơ và oxy của không khí:
N2 + O2 → 2NO
Ngoài ra, NO còn được tạo thành do quá trình oxy hóa các hợp chất có chứa nitơ trong nhiên liệu. Sau đó, NO có thể bị oxy hóa tạo thành NO2. Thông thường hầu như trong các nguồn phát thải NOx, NO đều chiếm hơn 90% lượng NOx.
NOx cũng được tìm thấy trong tầng bình lưu, có thể do quá trình oxy hóa nitơ oxit hoặc do khói thải của các máy bay.
Trong tầng đối lưu, NOx tham gia nhiều phản ứng hóa học với các tác nhân khác nhau, như O3, ánh sáng, gốc hydroxyl (OH), hydroperoxyl (HO2), các phân tử hữu cơ (bao gồm cả các gốc peroxyl hữu cơ, RO2), độ ẩm, các hạt lơ lửng (Hình 2.8). Ngoài các phản ứng hóa học, các quá trình vật lý như ngưng tụ khô và ướt cũng là các quá trình loại NO và NO2 trong khí quyển. Trong đó, các quá trình hóa học được xem là cơ chế sink chủ yếu của NOx , còn các quá trình vật lý là sink của PAN (peroxyacyl nitrate), HNO3 và N2O5.
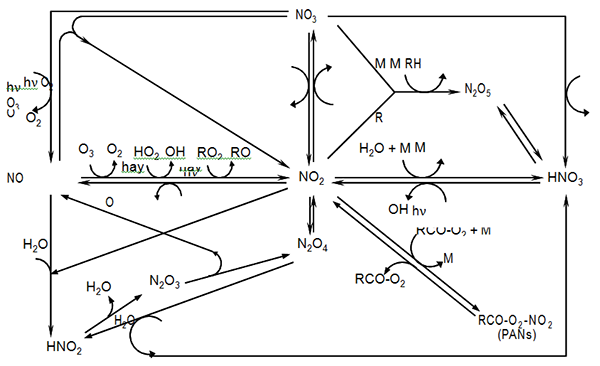
Hình 2.8. Các chuyển hóa hóa học chủ yếu của NOx trong tầng đối lưu [7]
Ozon trong tầng đối lưu có thể oxy hóa NO thành NO2:
NO + O3 → O2 + NO2
Đây là phản ứng nhanh, nhưng không xảy ra hoàn toàn. NO được tái tạo một phần đáng kể do NO2 tham gia phản ứng quang hóa sau:
NO2 + hν (λ < 430 nm) → NO + O
Nguyên tử oxy tạo thành có thể phản ứng với phân tử oxy để tái tạo ozon:
O + O2 + M → O3 + M
trong đó, M là cấu tử thứ 3 (có thể là một phân tử hoặc bề mặt rắn) cần thiết để hấp thụ năng lượng giải phóng ra khi tạo liên kết mới, làm bền hóa sản phẩm phản ứng.
Mặc dầu bản thân NOx đã là các chất gây ô nhiễm, nhưng các ảnh hưởng chính thường gây ra do các chất gây ô nhiễm thứ cấp được tạo ra từ NOx. Trong tầng đối lưu NOx bị oxy hóa thành axit nitric, tạo ra mưa axit. NOx là điều kiện cần để tạo ra sương khói quang hóa