Giữa tính chất và cấu tạo của chất hoạt động bề mặt có mối liên quan chặt chẽ với nhau.
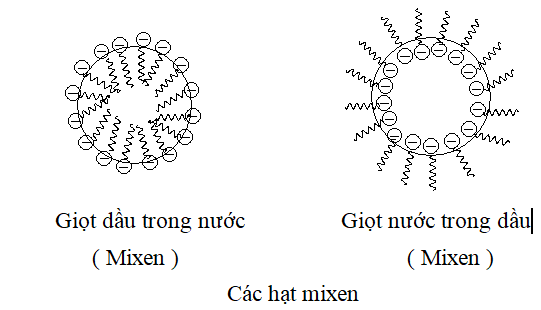
Sự hình thành mixen
Một tính chất quan trọng của dung dịch các chất hoạt động bề mặt là khả năng làm tăng độ hòa tan của các chất hữu cơ thực tế không tan trong dung dịch ví dụ dầu trong nước hoặc nước trong dầu. Ở dung dịch dầu trong nước các phân tử chất hoạt động bề mặt ( ví dụ các muối axit béo ) có đuôi ưa dầu cắm vào trong giọt dầu còn đầu ưa nước bao quanh phía ngoài còn ở dung dịch nước trong dầu thì đầu ưa nước của các phân tử chất hoạt động bề mặt chui vào phía trong giọt nước còn đuôi ưa dầu bao phía ngoài ,kết quả là các giọt dầu này tan được trong nước còn các giọt nước này tan trong dầu . Chính các giọt dầu hay giọt nước này là hình ảnh của các hạt mixen được hình thành trong dung dịch dầu/nước hay nước/dầu.
Nồng độ mixen tới hạn (CCM)
Khi tăng nồng độ của chất hoạt động bề mặt tới giá trị nhất định, chúng liên kết với nhau tạo nên các mixen. là một trong các dạng mixen hình cầu.
Nồng độ tới hạn là nồng độ cực đại của một chất tại áp suất P và nhiệt độ T không đổi mà hệ vẫn tồn tại đồng thể.
Hoạt tính bề mặt là tỉ số giữa nồng độ của hợp chất ở bề mặt chất lỏng [Cs] và nồng độ của nó trong dung dịch [Cv] :
Hoạt tính bề mặt =Cs/Cv
Đối với các chất thì tỉ số này là 1000 ở nồng độ mixen tới hạn.
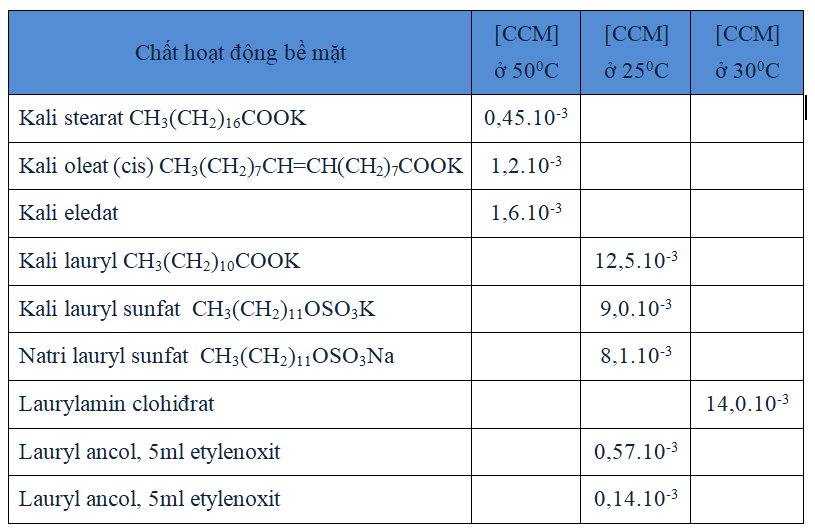
Nồng độ mixen tới hạn (CCM) là nồng độ của một chất hoạt động bề mặt trong dung dịch mà ở trên trên nồng độ đó thì một phần phân tử phân tán trong dung dịch đã tụ họp lại thành dạng mixen.
Đối với một hệ đã cho nếu nồng độ chất hoạt động bề mặt tăng thì sức căng bề mặt sẽ giảm đến một giá trị không đổi mặc dù nồng độ dung dịch vẫn tăng (hình 3.7).
Như vậy, giá trị hoạt tính bề mặt (HTBM) của một hợp chất được biểu thị theo công thức : (sO -sCCM )/ [CCM] = HTBM-
sO là sức căng bề mặt môi trường.
sCCM là sức căng bề mặt ở nồng độ mixen tới hạn.
[CCM] nồng độ mixen tới hạn
Đối với phần lớn các chất hoạt động bề mặt, sức căng bề mặt của chúng gần như nhau nhưng nồng độ mixen tới hạn thay đổi theo cấu tạo của chúng. Các tính chất khác như sự thấm ướt, tạo bọt, nhũ hóa cũng liên quan đến hoạt tính bề mặt.
Bảng 3.3. Nồng độ tới hạn mixen của một số chất
Sự thay đổi nồng độ mixen tới hạn.
Đối với một dãy đồng đẳng các chất hoạt động bề mặt mạch thẳng ở một nhiệt độ nhất định thì nồng độ mixen tới hạn tăng gấp đôi cho sự giảm đi mỗi nguyên tử cacbon mạch thuộc nhóm kị nước (hiđrophop) gắn với đầu ưa nước. Như vậy hai chất hoạt động bề mặt có số nguyên tử C hơn nhau là n, thì nồng độ tới hạn của chất có ít số C hơn bằng nồng độ tới hạn của chất kia nhân với 2n như công thức sau:
[CCM]2 = [CCM]1x2n
[CCM]1 là nồng độ tới hạn mixen của chất có mạch cacbon lớn hơn, [CCM]2 là nồng độ tới hạn mixen của chất có số cacbon ít hơn.
Ví dụ xét phân tử C13H27COOK (1) và C9H17COOK (2)
[CCM] của C13H27COOK = 0,006M-(miristat)
[CCM] của C9H17COOK = 0,095M-(caprat)
[CCM]2 = 0,006x24 = 0,096M
Hai muối này khác nhau 4 nguyên tử cacbon.
Tính chất này của các chất hoạt động bề mặt có thể viết dưới dạng tổng quát:
lg[CCM] = A – B.nC -(3.10)
A đặc trưng cho dãy chất hoạt động bề mặt;-B là giá trị giới hạn, nhỏ hơn lg2 = 0,3 ;
nC là số nguyên tử cacbon trong mạch.
A và B là các hằng số thực nghiệm. Số nguyên tử C của mạch hyđrophop càng tăng thì nồng độ tới hạn mixen càng giảm (xem bảng 3.4).
Bảng 3.4. Giá trị A và B của một số chất hoạt động bề mặt.
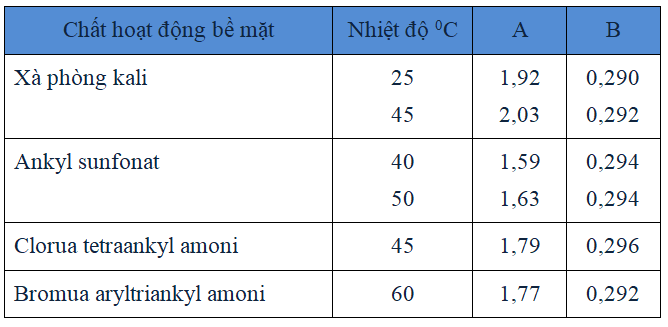
Ví dụ: chất C9H19COOK có lg[CCM] = 1,92 – 0,290x10 = -1,0
Do đó -- [CCM] = 0,10M-
Ở xung quanh nồng độ tới hạn một số tính chất của chất hoạt động bề mặt có sự thay đổi đột biến như áp suất thẩm thấu, sức căng bề mặt, độ dẫn điện, khả năng giặt rửa… chỉ ra những thay đổi tính chất của dung dịch đođexyl(lauryl)sunfat natri C12H25OSO3Na.
Phân tử chất hoạt động bề mặt chịu hai lực, một lực hướng nó vào trong môi trường nước, một lực kéo ra. Tính bền của bề mặt pha cần một cân bằng giữa hai khuynh hướng đó. Nếu người ta kiểm tra sự hoạt động của các hợp phần khác nhau đối với nước, ví dụ các hiđrocacbon không thể cho các lớp phân tử bền vững nếu tạo ra các pha ba chiều. Adam đã đưa ra bảng phân loại các nhóm theo tính chất ưa nước (bảng 3.5).
Bảng 3.5. Các nhóm ưa nước.
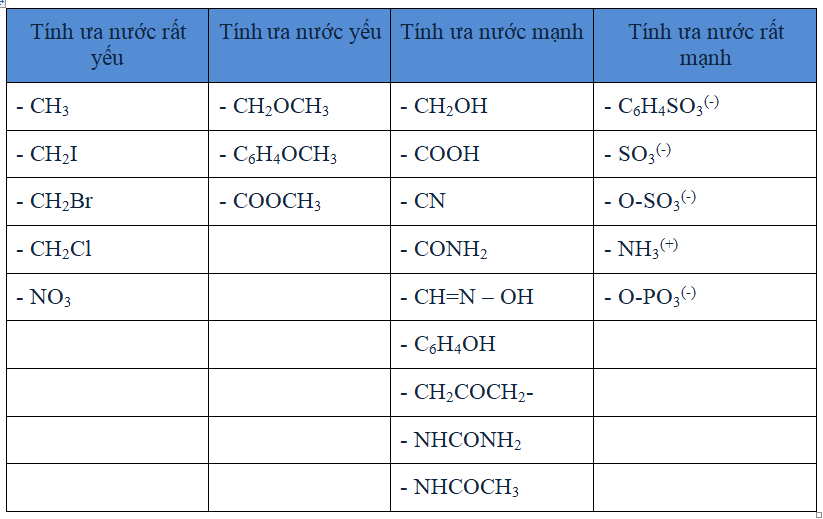
Từ bảng trên thấy rằng vị trí của các nhóm chức ưa nước, sự có mặt của liên kết đôi trong phân tử, sự phân nhánh, vị trí của chúng ảnh hưởng đáng kể đến tính chất sức căng bề mặt, cũng như tính chất vật lý và hóa học của chúng (oxi hóa, kháng hiđrolisơ)
Ảnh hưởng của chiều dài mạch và sự phân nhánh.
Ảnh hưởng của chiều dài mạch cacbon đến tính chất hoạt động bề mặt thường thấy rất rõ.
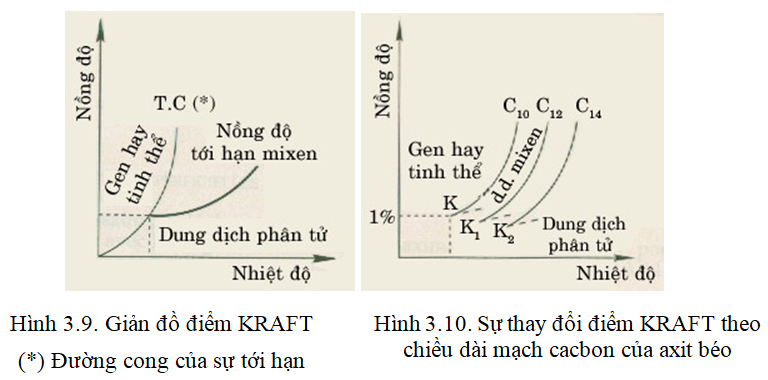
Điểm KRAFT.
Độ hòa tan của các chất hoạt động bề mặt là hàm số của cấu tạo của chúng và nhiệt độ. Đối với xà phòng và một vài chất hoạt động bề mặt khác, điểm KRAFT là nhiệt độ mà ở đó dung dịch chất hoạt động bề mặt trở nên đục khi làm lạnh. Đó chính là nhiệt độ tới hạn của sự hòa tan (hình 3.9).
Ở xà phòng và các chất hoạt động bề mặt khác sự kéo dài mạch cacbon đều gây ra sự thay đổi điểm KRAFT (hình 3.10). Theo sơ đồ này khí mạch cacbon tăng thì điểm KRAFT tăng.
Trái ngược với các chất hoạt động bề mặt có điện tích ion, các chất hoạt động bề mặt không ionic thường thể hiện điểm đục trong dung dịch nước thường phụ thuộc vào cấu tạo của hai phần kị nước và ưa nước. Ví dụ dãy etilenoxit gắn với gốc hiđrocacbon tăng lên thì điểm đục của các hợp chất không ionic càng tăng.
Đối với các hợp chất R–O–(CH2–CH2–O)n–H thì quy tắc chung là càng nhiều số phân tử oxytetilen liên kết với phân tử kị nước, điểm đục của các chất không ionic càng tăng. Ví dụ, RO(CH2CH2O)nH, khi n tăng thì điểm đục tăng.
Cũng vậy, trong một dãy đã cho, số nguyên tử cacbon trong mạch phần kị nước càng tăng thì điểm đục càng giảm, đó là trường hợp ancol béo etoxyl hóa.
Một số hợp chất không ionic cho điểm đục thấp ở nhiệt độ môi trường, người ta phải đo nó khi có mặt dung môi thứ ba. Phần lớn các hợp chất không ionic có điểm đục nằm trên điểm sôi của nước. Đối với hệ này người ta đo ở môi trường nước muối. Ở hai hệ trên rõ ràng điểm đục được cho dựa trên môi trường đo nó.
Trọng lượng mixen.
Số lượng phân tử ở dạng mixen và trọng lượng mixen tăng lên cùng với chiều dài mạch cacbon. Ví dụ ancol béo sunfat cho trọng lượng mixen tăng lên ở bảng 3.6.
Bảng 3.6. Trọng lượng mixen tăng theo mạch cacbon ở ancol béo sunfat.
Tính chất bề mặt.
Năng lượng cần thiết để rời chỗ một phân tử ở bề mặt tăng lên với chiều dài mạch, năng lượng giải hấp W được cho theo phương trình:
W = lp + n. WC
W-: năng lượng giải hấp
lp-: phụ thuộc nhóm phân cực
n-: số nguyên tử C trong mạch
WC-: năng lượng giải hấp của nhóm CH2. Nó bằng 600 Calo cho một nhóm CH2
Thực tế cứ tăng một nhóm CH2 của mạch lên thì sức căng bề mặt giảm đi ba lần. Theo qui tắc Adam, sự tăng chiều dài mạch một nhóm CH2 sẽ làm thay đổi tính chất lớp bề mặt cũng như giảm nhiệt độ đi 8/100C.
Tính chất thấm ướt.
Tính chất thấm ướt tăng lên khi mạch cacbon tương ứng 8-10 cacbon.
Tính chất tạo bọt.
Sự tạo bọt cực đại ở 20-400C đối với các chất có mạch cacbon từ 12-14 cacbon.
Tính chất nhũ hóa.
Tính chất nhũ hóa tăng lên đối với hợp chất có từ 16-18 nguyên tử cacbon.
Tính chất giặt tẩy.
Tính chất này thay đổi tùy từng trường hợp. Ví dụ ở dưới điểm KRAFT, mạch dài cho kết quả tốt nhất. Ở dưới 600C tác dụng giặt tẩy tăng đặc biệt đối với mạch dài C18.
Ảnh hưởng của nhóm thế phân nhánh.
Theo qui tắc chung sự phân nhánh chống lại mối liên kết giữa các phân tử với nhau, điều này phá rối bề mặt tiếp giáp, làm giảm điểm KRAFT và sức căng bề mặt. Do vậy sự phân nhánh làm thuận lợi cho sự tạo bọt và làm hại độ bền của nhũ.
Các chất phân nhánh là chất tạo bọt tốt nhưng là chất giặt tẩy kém. Bản chất của các nguyên tử tạo thành mạch nhánh có ảnh hưởng đến tính chất của nó, đó là trường hợp hợp chất flo, đã làm tăng hoạt tính tạo bọt lên mạnh.
Cân bằng hiđrophin/lipophin (ưa nước/ưa dầu) HLB-RHLB
Nghiên cứu cân bằng hiđrophin/lipophin hay HLB chi ra khả năng hoà tan trong nước và khuynh hướng bị hấp phụ ở bề mặt của chất hoạt động bề mặt hay khả năng làm giảm sức căng bề mặt của nó trong dung dịch nước ở pha phân tán là nước hay một pha hữu cơ phổ biến nhất là dầu. Có mặt nhũ dầu, ở đấy pha phân tán là nước, hay có mặt pha phân tán nước ở đấy có nhũ dầu.